
0. 들어가며
2024년도 3월에 시행된 3월 모의고사 화학1 주요 기출문제 해설을 진행해 보고자 한다. 글로 표현하는 특성상 전달력이 떨어질 수 있음에 양해를 구하며 시작해 보도록 하겠다. 주요 문항이라는 말 자체가 다소 주관성을 포함하고 있기는 하지만, 그래도 어느 정도 공감대는 형성되지 않을까 하는 마음을 가지며.. 시작해 보자.
1. 2번
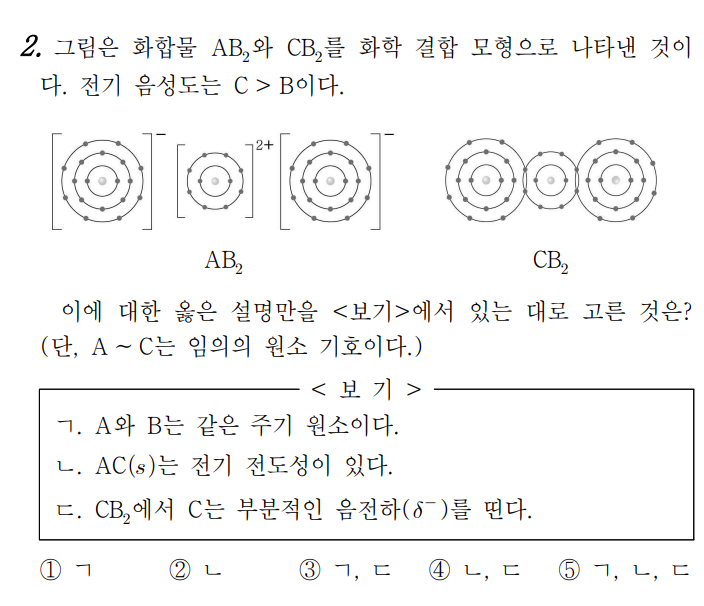
전형적인 유형이다. 공유결합과 이온결합의 구조와 관련한 문항을 수월하게 풀이하기 위해서는, 반드시 모형 자체의 암기를 필요로 한다. 18족의 전자 배치를 기준으로 생각하면 편하다. 예컨데 A는 네온의 전자 배치를 하지만, 2+의 전하량을 가지므로 마그네슘(Mg)이 된다. 공유 결합의 경우에도 같은 방식으로 생각하면 된다. C의 경우 네온의 전자 배치를 하지만, 두 개의 B와 공유 결합을 형성하므로 16족의 산소(O)가 된다.
ㄱ. A와 B는 각각 양이온과 음이온이며, 양이온이 네온의, 음이온이 아르곤의 전자배치를 한다는 것은 이들이 같은 주기에 존재함을 시사한다.
ㄴ. 이온 결합 화합물은 고체 상태에서 전기 전도성이 없다. 자주 빈출되는 문장이며 의외로 실수가 많이 나오는 문항이니 유의해서 풀이하길 바란다.
ㄷ. 부분 전하는 전기 음성도에 의해 결정된다. 문제에서 전기 음성도가 C가 더 크다고 하였으므로, C는 부분적인 음전하를 띤다. 다만, 고득점을 위해서는 원자번호 20번 이내의 전기 음성도는 반드시 암기하기 바란다.
정답 3번
2. 5번

쉬운 난이도의 산화 환원 반응식 문항이다. 정석적으로는 각각의 산화수를 적으며 진행하지만, 여기서는 조금 더 사고해 볼 만한 생각을 정리해 보고자 한다. 즉, 시험적 해석이다.
ㄱ. 아이오딘화 이온이 아이오딘이 된다는 것은, 필연적으로 전자를 잃음을 의미한다. 만일 전자를 잃는 것이 곧 산화이고, 그 결과 산화수는 증가한다는 사실을 숙지하고 있다면, ㄱ은 오답임을 쉽게 파악할 수 있다. 어렵다면 산화수법을 이용해서 그냥 구하면 된다.
ㄴ. 전하량 보존 법칙에 의해, 잃은 전자와 얻은 전자는 항상 동일해야 한다. 아이오딘화 이온은 전자를 1개 잃으며, 그러한 아이오딘화 이온이 2개 존재하므로 이동한 전자는 총 2개이다. 한편, 망가니즈의 산화수는 +4이므로 (산소가 -2이기 때문이다. 그 이유는 생략한다) 전자 2개는 그대로 망가니즈에게 이동한다. 따하라 n=2이다.
ㄷ. 아이오딘화 이온이 산화되었으므로, MnO2는 산화제가 된다. 산화 환원은 동시성을 가짐을 기반으로 한 논리이다.
정답 2번
3. 6번

ㄱ. 먼저 ㉠이 어떤 물질인지를 찾아야 하는데, 접근 방법은 (가)와 (나) 중 어떤 것을 봐도 무방하다. (나)의 수산화 마그네슘은 염기이고, 염산은 산이므로, 이들의 반응은 중화 반응이다. 중화 반응에서는 반드시 물이 생성되므로, ㉠은 H2O이다.
ㄴ. 수산화 마그네슘에 존재하는 산소가 총 2개이므로, b는 2이다. 따라서 수소의 총 개수는 4개이므로, a도 2이다.
ㄷ. 질량을 물어볼 때는 항상 질량=몰X분자량(몰질량)임을 상기하자. 다만 이 문제는 직접 계산이 없어도 풀이할 수는 있는데, 간단히 생각해보면 이것이다. 반응물에서 각 물질과 염산 사이의 반응 계수비는 각각 1 : 1 과 1 : 2이므로, 동량의 염산이 반응한다면 각 물질의 반응비는 2 : 1이 된다. 즉, 몰수비가 2가 되는것이다. 한편, NaHCO3의 화학식량이 더 크므로, 이 값은 계산해 볼 필요도 없이 2를 초과하게 된다.

위 문제에서 적용시켜 보면, 몰수비가 2인 상황에서 화학식량의 차이가 이미 나므로, 2 초과는 검산과 관계없이 참인 명제라는 말이 된다.
반드시 암기까지 해야할 스킬은 아니지만, 귀류를 이용한 문제풀이는 시간단축에 효과적이다. 잘 활용할 수 있으면 좋겠다.
정답 5번
4. 7번

ㄱ. 오비탈과 관련한 문제이다. 오비탈 문제는 시간 단축이 생명이라 해도 과언이 아닌 파트이다. 먼저, 특숫값을 찾는다. p 오비탈에 들어 있는 전자 수 / s 오비탈에 들어 있는 전자 수의 값이 1인 원소는 O, Mg 이렇게 두 개 뿐이다. 여기에서, 조금의 총명함이 있다면 X가 바로 O임을 눈치챌 수 있는데, 그 이유는 바로 홀전자 수에 있다. Mg의 홀전자수는 0개이므로, X가 Mg가 되면 Y의 홀전자수는 음수가 된다. 이는 모순이므로, X는 O이고, a=2이다.
ㄴ. 한편 1.5에 해당하는 원소 역시 Ne, P의 두개이고, a=2이므로 Z는 P가 된다. 홀전자 수가 1개이며, 5/4를 만족하는 원소는 F가 된다. 원자가 전자 수는 족을 따르므로, 산소의 원자가 전자 수는 인의 원자가 전자 수보다 1개 더 많다.
ㄷ. P는 3주기이고, F는 2주기이므로, 비교할 이유 없이 오비탈 수는 P가 더 많다.
정답 5번
5. 8번

ㄱ. 자료 해석을 하기도 전에 눈에 들어왔어야 맞다. 동위 원소의 정의는 양성자 수는 같지만 중성자 수는 다른 서로 다른 원소를 말한다. 질량수는 양성자 수와 중성자 수의 합으로 정의되므로, 두 동위 원소의 질량수의 차이는 오직 중성자수에서 기인한다. 즉 중성자수는 m+2일 때가 더 많을 수밖에 없다.
ㄴ. 한편 우리는 A가 분자 내에 총 몇 개 존재하는지 모르는 상태인데, 서로 다른 분자량의 개수가 4가지 존재한다. 이때 중요한 아이디어는 분자량이 가장 작은 녀석은 원자량이 m인 A만 존재하는 것이고, 분자량이 가장 큰 녀석은 원자량이 m+2인 A만 존재한다는 것이다. 이들의 분자량 차이가 6이 되기 위해서는, A는 반드시 3개 존재해야 한다. a=3이다.
ㄷ. 평균 원자량은 각 동위원소의 존재비를 고려해야 한다. 분자량이 가장 큰, 작은 분자의 존재비율이 같으므로, 이들은 1 : 1의 존재비를 가진다. 즉 평균 원자량은 중점이며, m+1이다.
정답 4번
6. 10번
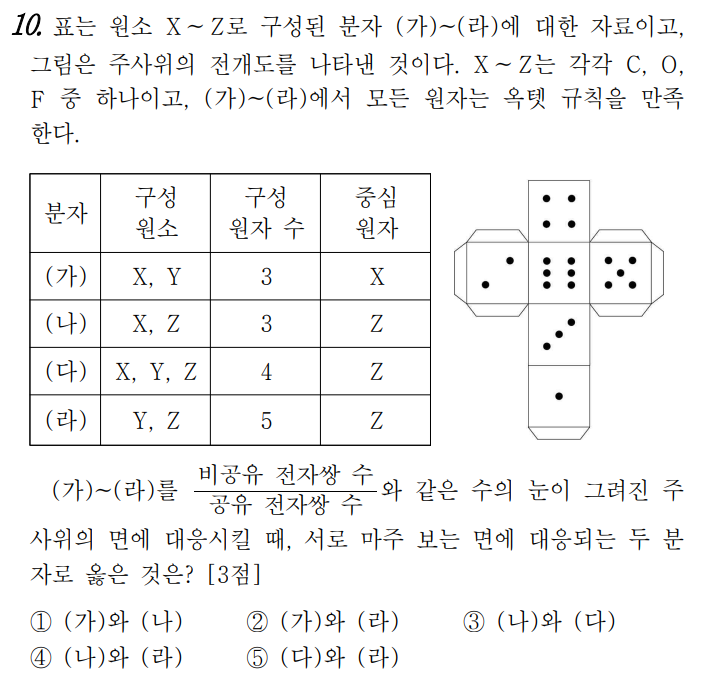
상당히 독특하게 출제된 문제라고 생각한다. 다만 문제의 난이도 자체는 그렇게 높지 않으니 쫄지 않으면 맞출 수 있었으리라 생각한다. 일단 분자의 구조 문제에서는 빈출되는 주제가 있으므로 잠깐 정리를 해보면 (2주기라는 전제이다)
1) 구성 원소가 X, Y / X, Z의 형태로 나타났을 때 - 반드시 CO2와 OF2를 먼저 떠올린다.
2) 구성 원소가 X, Y, Z이고 구성 원자 수가 4개인 경우 - 반드시 CF2O를 먼저 떠올린다. (1주기 포함시 CH2O)
3) 구성 원소가 X, Y이고 원자 수가 5개인 경우 - 반드시 CF4를 먼저 떠올린다. (1주기 포함시 CH4)
CO2 의 경우 비공유/공유 = 1 의 특숫값을 가지므로, 기억해두면 편리하다. 결과적으로, (가)~(라)는 각각 4 1 2 3이다. 마주보는 것은 (가)와 (라)이다.
정답 2번
7. 12번

1) 용질의 질량의 비가 1 : 3인데, 몰 농도와 부피가 같으므로, 이는 분자량비이다. 즉 Y의 분자량/X의 분자량 = 3이다.
2) 같은 용질에 대해 (나)와 (다)에서 몰수비가 1 : 2이므로, 0.25a : 0.1V = 1 : 2이다. 즉, a/V=1/5이다.
익숙해지고 나면 매우 쉬운 문제이다. 다만 처음에는 이러한 사고전환이 쉽지 않을 수 있다. 많이 연습해 보기 바란다.
정답 5번
8. 13번

1) 먼저 바닥상태 질소임을 생각하자. 1s 2s 그리고 2p까지가 포함된다. n+l은 각각 1 2 3이다. 따라서 (가)는 1s (나)와 (다)는 2p 오비탈의 전자이다.
2) 아래 식의 2l + ml + 1/n의 경우, 2l+1/n은 상수처럼 따라감을 이해해두면 좋다. 표로 표현하면 다음과 같다.
| 1s | 2s | 2px | 2py | 2pz | |
| n | 1 | 2 | 2 | 2 | 2 |
| l | 0 | 0 | 1 | 1 | 1 |
| n+l | 1 | 2 | 3 | 3 | 3 |
| 2l+1/n | 1 | 1/2 | 3/2 | ||
| ml/n | 0 | 0 | -1/2 | 0 | 1/2 |
이에 따라, (라)는 2s 오비탈이며, x=2이다.
3) 수소 원자를 제외한 모든 원자에서는 주양자수 + 부양자수의 값으로 에너지 준위를 정한다. 따라서 (나)와 (라)의 에너지 준위는 (크기 여부를 떠나) 다르다.
정답 1번
9. 15번

쉬운 난이도의 금속의 반응성 유형이다. 과거엔 킬러 문항으로 출제되었으나 현재는 다소 완화되어 출제되고 있고, 한 때는 완전히 자취를 감추었다가 최근 다시 보여주고 있는 유형이라고 볼 수 있겠다. 금속의 반응성 문제에서 가장 중요한 것은 전하량 보존 법칙이다. 총 양전하의 개수는 변하지 않음을 유의하며 문제를 풀이하면 좋다. 또한, 문제에서 나와있듯이 큰 이변이 없는 한 전하량은 3 이하의 자연수이므로, 최소 정수비로 빠르게 전하량을 구하면 좋다.
ㄱ. B를 넣으면 반응이 일어나므로, B는 산화 A는 환원된다.
ㄴ. A가 6N몰 존재했으므로(이하 N은 생략한다), 총 전하량은 6m이다. 이는 B만 존재하는 (가)에서도 마찬가지이므로, 6m = 9n이라는 관계식이 성립한다. m : n = 3 : 2이므로, 둘의 합은 5이다.
ㄷ. (나)에서는 B와 C가 합쳐서 12몰 존재하며, 전하량의 합은 18이다. 따라서 1 : 1의 존재비로 존재해야만 18을 맞출 수 있다.
정답 3번
10. 17번

상댓값을 제시한 pH문제이다. 또한 pH와 pOH의 차를 절댓값으로 준 점을 주목할 만 하다.
1) pH가 (가)가 (다)의 3배이므로, pH의 비는 3 : 1 이다. 편의상 3a a 라고 한다면, pOH는 14-3a 14-a가 된다. 결과적으로 이 비율인 14-3a/3a : 14-a/a = 1 : 15이므로, 14-3a : 42-3a = 1: 15가 성립한다. 따라서 a는 4이다.
2) 이에 따라, (가)의 pH=12 / (다)의 pH=4가 된다. |pH-pOH|는 각각 10, 6이므로, y=6이고, (나)의 |pH-pOH|=2가 되며 산성 수용액은 2가지라고 하였으므로, (나)는 산성이다. 이에 따라 x=8이 된다. 따라서 x-y=2이다.
3) (가)의 pOH=2이고, (나)의 pH=4이므로, 둘의 몰 농도 비는 1/100이다. 한편, 둘의 부피비는 4이므로, 이를 곱한 값은 1/25이다.
정답 3번
11. 18번

정답 5번
12. 19번

킬러문항인 중화반응 유형이다. 지난날에 비해 많이 어렵게 나오지는 않았다. 순서대로 차근차근 따라가보자.
1) (가)에서 HCl과 NaOH가 반응한 결과 양이온이 두 가지 존재한다. 따라서, 용액의 액성은 산성이다. 구경꾼 이온인 Na+가 H+와 1 : 1의 비율을 나타내므로, HCl과 NaOH 둘의 몰수비는 2 : 1이다. 따라서 몰 농도 비는 6 : 1이 된다.
2) 이를 (나)에서 가져와 보면, (나)에서 HCl과 NaOH의 몰수비는 3 : 1이다. (몰농도와 부피의 비를 곱했다) 이 때 H+는 반응 결과 모두 소모되었고(그림을 통해 확인 가능하다), X2+는 Na+와 동량 존재하므로, HCl과 NaOH, X(OH)2의 몰수비는 3 : 1 : 1 이다. 결과적으로 (나)는 중성이며, 세 물질의 몰 농도 비는 6 : 1 : 2가 된다.
3) (다)에서는 양이온이 세 종류 존재하므로, 액성은 산성이다. 한편, 세 양이온의 몰수비가 H+ Na+ A2+ 순서대로 2 : 1 : 3이므로, 최초 몰수비는 9 : 1 : 3이다. 몰수비는 몰농도와 부피의 곱인데, 몰농도의 비는 6 : 1 : 2이므로, 부피비는 3 : 2 : 3이다.
4) 이에 따라 정리하면 1/3이 된다.
정답 1번
13. 20번

킬러 문항인 양적관계이다. 천천히 해석해보면 정답에 이를 수 있다. 기본적으로 알 수 있는 것들부터 정리한다.
1) 질량비는 몰수비와 무관하지만, 같은 물질의 질량비=몰수비가 성립한다. 즉, (가)와 (나)에서 B는 3 : 4의 몰수비를 가진다.
2) 한편, (나)에서 A가 모두 반응하였다면, 설사 B 역시 모두 반응하였다 한들 (가)에서 역시 A가 한계 반응물이 된다. (이 경우 B가 16w 반응해야 하기 때문이다) 따라서 두 실험의 한계 반응물은 모두 A이다.
3) 한편 반응 전후에 질량은 불변하므로(질량 보존의 법칙), 기체의 밀도비는 기체의 부피비에 반비례한다. 즉, 반응 전후에 (가)는 5 : 4, (나)는 4 : 3의 부피비를 가지며, 아보가드로 법칙이 성립하므로, 몰수비 역시 동일하다.
4) A를 (가)와 (나)에서 각각 a, 2a몰이라 가정하고, B를 3b 4b몰이라 가정하면, (가)의 반응 전 몰수는 a+3b, 반응 후 몰수는 3b+1이 되며, (나)의 경우 각각 2a+4b, 4b+2 가 된다. 이들은 각각 5:4와 4:3이므로, a=2 b=1이 된다.
5) 따라서 반응 몰수비는 2 : 1 : 2이므로, 실제 계수 a=2가 된다.
6) 또한 반응 질량비는 15 : 8 : 23이므로, 이에 따라 분자량비는 15 : 16 : 23이 된다. 정리하면 23/8이 된다.
정답 2번
to be continued..
Edited 2024.11.12
Edited by 푸른삿포로
[Update]
#241113 후반부 문항 해설 추가 (18번 제외)
댓글