
1. 물질의 분류
물질의 특성을 이해하기에 앞서, 우리는 물질이란 무엇인가에 대해 이해할 필요가 있다. 물질이란 무엇일까. 간단하게 말하면, 공간을 차지하고(부피), 질량을 가진 것을 물질이라 정의한다. 그렇다면, 물질을 더 세세하게 구분해 보자.
물질은 크게 두 가지로 분류한다. 순수한 물질인 순물질과, 그러한 순물질들이 섞여있는 혼합물이다. 순물질은 다시 정말 순수하게, 한 종류의 원소로만 이루어져 있는 원소(홑원소 물질)와, 두 개 이상의 원소로 이루어진 화합물로 구분된다. 한편 혼합물은 두 혼합 상태를 분리할 수 있는지 여부에 따라서 구분된다. 두 물질이 완전히 섞여 서로를 구분할 수 없는 경우를 '균일 혼합물' 이라고 하며, 두 물질을 구분할 수 있다면 '불균일 혼합물'이 된다.


| 물질(matter) | 순물질(pure substance) | 원소(element) | ex. H2, O2, He, Ne |
| 화합물(compound) | ex. H2O, CO2, NH3 | ||
| 혼합물(mixture) | 균일 혼합물(homogenous mixture) | ex. 소금물, 설탕물 | |
| 불균일 혼합물(heterogenous mixture) | ex. 우유, 콜라, 흙탕물 |
위의 설명을 표로 표기하였다. 특히 화합물과 혼합물이라는 명칭이 많이 혼동될 수 있으므로, 잘 체크해 두기 바란다.
2. 끓는점, 녹는점과 어는점
위에서 간단한 물질의 분류에 대해서 언급하였는데, 우리는 과학적으로 들어가지 않더라도, 물과 소금의 차이를 구분한다. 또한 에탄올과 물의 차이 역시 구분할 수 있다. 이렇듯 우리는 물질을 육감적으로도 구분할 수 있는데, 그것은 바로 각각의 물질이 가지는 고유한 '성질'이 있기 때문이다. 특정 물질이 가지는 고유한 성질을 '물질의 특성' 이라고 한다.
물질이 가진 특성은 다양한 종류가 있는데, 그 중에서 우리는 끓는점, 녹는점, 어는점 그리고 밀도와 용해도에 대해서 다뤄보도록 하자.

먼저 끓는점, 녹는점, 어는점에 대해 정의해 보자. 1학년 과학에서 이미 다루어진 내용이니 단어 자체가 어색한 학생들은 아마 없을 것이다. 끓는점이란 물질이 액체에서 기체, 즉 기화하는 순간의 온도이며, 녹는점은 고체가 액체로 융해, 어는점은 액체가 고체로 응고되는 시점의 온도이다. 즉, 특별한 경우를 제외하고 녹는점과 어는점의 값은 같다.
끓는점, 녹는점, 어는점은 물질의 특성이다. 다시 말해, 어떤 물질의 끓는점, 녹는점, 어는점은 항상 같다. 물이 1g이 있어도, 1만g이 있어도 물은 100도에서 끓는다. 그렇기에, 우리는 100도에서 끓는다는 물질의 특성을 보고, 해당 물질이 물임을 유추할 수 있다.

그렇다면 물에 소금을 넣어 소금물을 만들면 어떻게 될까. 순물질인 물에 순물질인 소금을 넣으면, 그 순간부터 그들은 순수함을 잃는다. 소금물은 혼합물, 그 중에서도 균일 혼합물이다. 따라서, 더 이상 끓는점은 100도가 될 수 없다. 일반적으로 끓는점은 100도를 넘게 되며, 끓는점이 일정하지 않게 된다. 여기에서 우리는 해당 물질이 순물질인지, 혼합물인지를 구분할 수 있다.
그러나 같은 물질임에도 불구하고 끓는점 곡선에서는 한 가지 차이가 발생할 수 있는데, 그것은 바로 끓는점에 도달하는 '시간'의 차이이다. 단순한 예를 들어보자. 물 1g과 100g 중 어떤 것이 먼저 100도에 도달하겠는가? 단위 시간당 가해주는 열량이 같다면, 당연히 물 1g이 먼저 100도에 도달하게 될 것이다. 즉, 물질의 양은 끓는점에 도달하는 시간에 영향을 주며, 끓는점의 수치에는 영향을 미치지 않는다.
3. 밀도
두 번째로 다뤄볼 특성은 밀도이다. 밀도는 초등학교 식으로 말하자면 '빽빽한 정도'이다. 조금 더 과학적으로 이야기해 보면, 단위 부피당 물질이 가진 질량이라고 말할 수 있다. 신기하게도 이 단위 부피당 물질이 가진 질량은 모든 물질이 다르다. 이는 다시말해 '물질의 특성'이라는 의미이다.
밀도 = 질량/부피 (d = m/V)
밀도가 크다는 것은 무엇을 의미할까. 액체상의 물질을 이용하여 여러가지 물질을 한 곳에 섞으면, 밀도가 높은 물질은 아래로 가라앉고, 밀도가 낮은 물질은 위로 뜬다.
밀도는 단위 부피에 대한 질량이다. 질량은 '질량 불변의 법칙'에 의해 변하지 않는 값이지만, 부피는 온도 조건에 의해서 변하게 된다. 이는 샤를의 법칙에서 다룬 바 있다. 따라서 고체, 액체, 기체 할 것 없이 온도가 높아지면, 밀도는 감소하게 된다.
한편 우리는 '보일의 법칙'에 대해서도 다룬 적이 있는데, 이는 부피와 압력이 반비례 관계에 있다는 법칙이었다. 즉, 압력이 높아지면 부피는 감소하게 된다. 고체와 액체의 경우 압력에 의한 부피 변화가 거의 없으나, 기체의 경우 압력에 의한 부피 변화가 크다. 즉, 기체의 밀도는 압력의 영향을 받으며, 압력이 커질수록 부피가 감소하여 밀도가 증가하게 된다.
| 압력 | 온도 | |
| 고체, 액체 | 거의 영향 받지 않음 | 온도 증가시 밀도 소량 감소 |
| 기체 | 압력 증가시 밀도 증가 | 온도 증가시 밀도 대량 감소 |
한편 혼합물의 밀도는 어떠할까. 물에 소금을 타는 순간 물은 순수함을 잃어버린다. 따라서 물은 본연의 밀도 역시 잃어버리게 된다. 실제로 물에 소금을 녹이면 밀도가 높아지게 된다. 따라서 물 속에 달걀을 넣어놓고 그 안에 소금을 계속 녹여주면, 어느 시점에서 달걀이 떠오르는 현상을 관찰할 수가 있는데, 이는 달걀의 밀도가 소금물의 밀도보다 작아져서 생기는 현상이라고 불 수 있겠다.
4. 용해도
마지막으로 다룰 물질의 특성은 용해도이다. 용해도에 대해 이야기하기에 앞서, '용해'란 무엇인지에 대해 논할 필요가 있다. 어떤 물질을 다른 물질에 녹이려는 상황을 상상해 보자. 이때 녹여지는 물질을 '용질(solute)'이라고 하며, 녹이는 역할을 하는 물질을 '용매(solvent)'라고 한다. 소금물의 경우 소금이 용질이며, 물이 용매가 된다. 그리고 이러한 과정을 '용해(solvation)'라고 하며, 이 결과 만들어지는 것을 '용액(solution)'이라고 한다. 이렇게 만들어진 용액은 두 혼합물을 구분할 수 없으므로, 용액은 균일 혼합물의 다른 말이라고 볼 수 있다.
그렇다면 용해도란 무엇일까. 용해도는, 물 100g을 기준으로 해당 용질이 녹을 수 있는 최대 질량을 의미한다. 즉, 각 물질이 물에 녹을 수 있는 최대의 양은 정해져 있다. 따라서 용해도는 물질의 특성이다.
고체와 기체는 용해도에 대해 차이를 보인다. 먼저 고체에 대해 이야기해 보자. 설탕을 물에 더 많이 녹이고 싶다. 물의 양을 일정하게 유지해야 한다면, 어떤 방법을 사용할 수 있을까. 그것은 바로 물을 가열해주는 것이다. 다시 말해, 온도가 증가하면 고체의 용해도는 증가하게 된다.
이렇게 녹인 용액을 급속하게 냉각시킨다고 생각해보자. 이렇게 되면 물질의 용해도가 급격히 감소하게 되며, 감소한 만큼의 용질은 다시 고체가 되어 나와야 한다. 이러한 현상을 '석출' 이라고 한다.
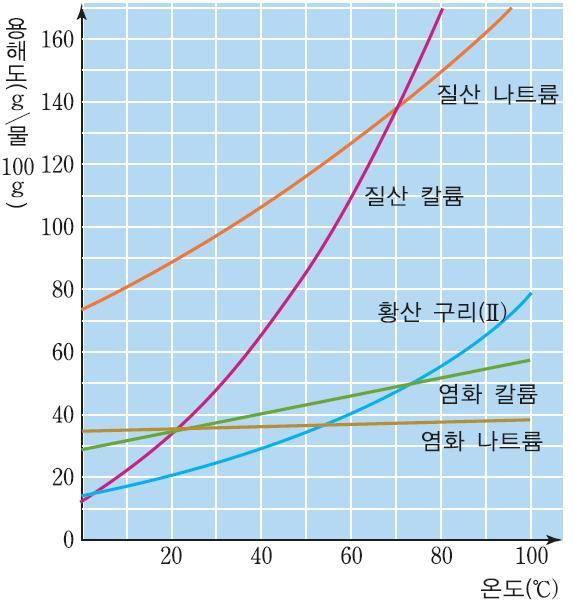
한편 기체의 용해도는 고체와 다른 양상을 보인다. 기체를 녹이기 위해서는, 그냥 기체 상태인 것 보다는 다소 액체에 가까운 온도를 가지는 것이 유리할 것이다. 즉, 기체의 용해도는 온도가 낮을수록 높아진다. 한편 온도가 낮아지면 기체의 부피가 작아지는데, 같은 원리로 압력을 높게 가한다면 기체의 용해도는 증가한다. 다시말해, 기체의 용해도는 온도가 낮을수록, 압력이 높을수록 증가한다는 것이다.
| 압력 | 온도 | |
| 고체 | 거의 영향 받지 않음 | 온도 증가시 용해도 증가 |
| 기체 | 압력 증가시 용해도 증가 | 온도 감소시 용해도 증가 |
Edited. 21.09.28
Edited by 푸른삿포로
[Update]
#241031 썸네일 추가 / 목차 추가 / Edited by 추가
'# 중등과학 > 중2 - 과학적 접근법' 카테고리의 다른 글
| 19. 수권, 분포, 그리고 순환 (0) | 2021.10.05 |
|---|---|
| [2021] 18. 혼합물의 분리 (0) | 2021.10.01 |
| 16. 배설 (0) | 2021.09.24 |
| 15. 호흡 (0) | 2021.09.21 |
| 14. 순환 (0) | 2021.09.17 |




댓글